La batterie lithium-ion : comment ça marche ?
Lecture 5 min
Conçues il y a plus de 30 ans, les batteries dites « lithium- » sont devenues omniprésentes dans notre vie quotidienne. Elles peuvent être de très petite taille dans un téléphone portable ou assemblées par dizaines dans une voiture électrique. Elles sont l’objet d’intenses recherches dans le monde compte tenu de l’enjeu que constitue le stockage de l’ .

© TOSHIFUMI KITAMURA / AFP - Les cellules de base lithium-ion sont montées par centaines pour alimenter les véhicules électriques ou hybrides (ici la Prius de Toyota).
Le fonctionnement d’une batterie
Les batteries et les piles sont des équipements qui transforment l’énergie chimique en énergie électrique. Une batterie (ou accumulateur) peut stocker et accumuler l’énergie électrique pour la restituer. Elle peut donc se charger et se décharger, selon des opérations réversibles. Une pile électrique fournit l’électricité à un circuit extérieur jusqu’à l’épuisement de son potentiel1.
Une batterie est formée de deux électrodes, plongées dans un électrolyte, une substance conductrice liquide ou solide, et reliées à l’extérieur par un fil conducteur. Quand la batterie se décharge, l’électrode négative (anode) émet des électrons qui passent par le fil et sont absorbées par l’électrode positive (cathode). Ce mouvement d’électrons constitue un courant électrique qui peut être ensuite transformé pour faire tourner un moteur ou faire fonctionner un appareil électronique. Pour équilibrer cet échange d’électrons, un échange d’ions positifs s’effectue entre les deux électrodes via l’électrolyte. Quand la batterie est en phase de recharge, avec un apport extérieur d’électricité, les mouvements sont inversés.
Les différents types de batteries
Les batteries utilisent des couples de matériaux capables d’échanger facilement et longtemps des électrons et des ions positifs. La batterie la plus courante dans les véhicules à moteur thermique est dite « au plomb », avec une électrode négative en plomb, une électrode positive en oxyde de plomb, et un électrolyte constitué d'acide sulfurique et d'eau. D’autres types de batteries utilisent le nickel, le cadmium, le sodium, le soufre, etc.
Le lithium a suscité l’intérêt car c’est un métal très léger, le troisième dans la classification des éléments après l’ et l’hélium. L’ de lithium a une forte capacité à libérer un de ses trois électrons, constituant ainsi un ion chargé positivement, Li+. Les constructeurs ont d’abord utilisé le lithium métal pour constituer l’électrode négative, émettrice d’électrons. Mais il est apparu que la répétition de cycles charges-décharges l’altérait. Pour y remédier, la cathode est souvent formée d’oxyde de cobalt, avec un peu de lithium, tandis que l’anode est faite de graphite. L’électrolyte est constitué de sels de lithium dans un solvant et contient donc des ions lithium en grande quantité. D’où l’appellation batterie lithium-ion.
La cellule de base lithium-ion
L’élément de base est une cellule qui se présente un peu comme un feuilleté : une plaque d’aluminium servant à collecter le courant, puis la cathode, l’électrolyte, puis l’anode, enfin une plaque de cuivre (voir le schéma).
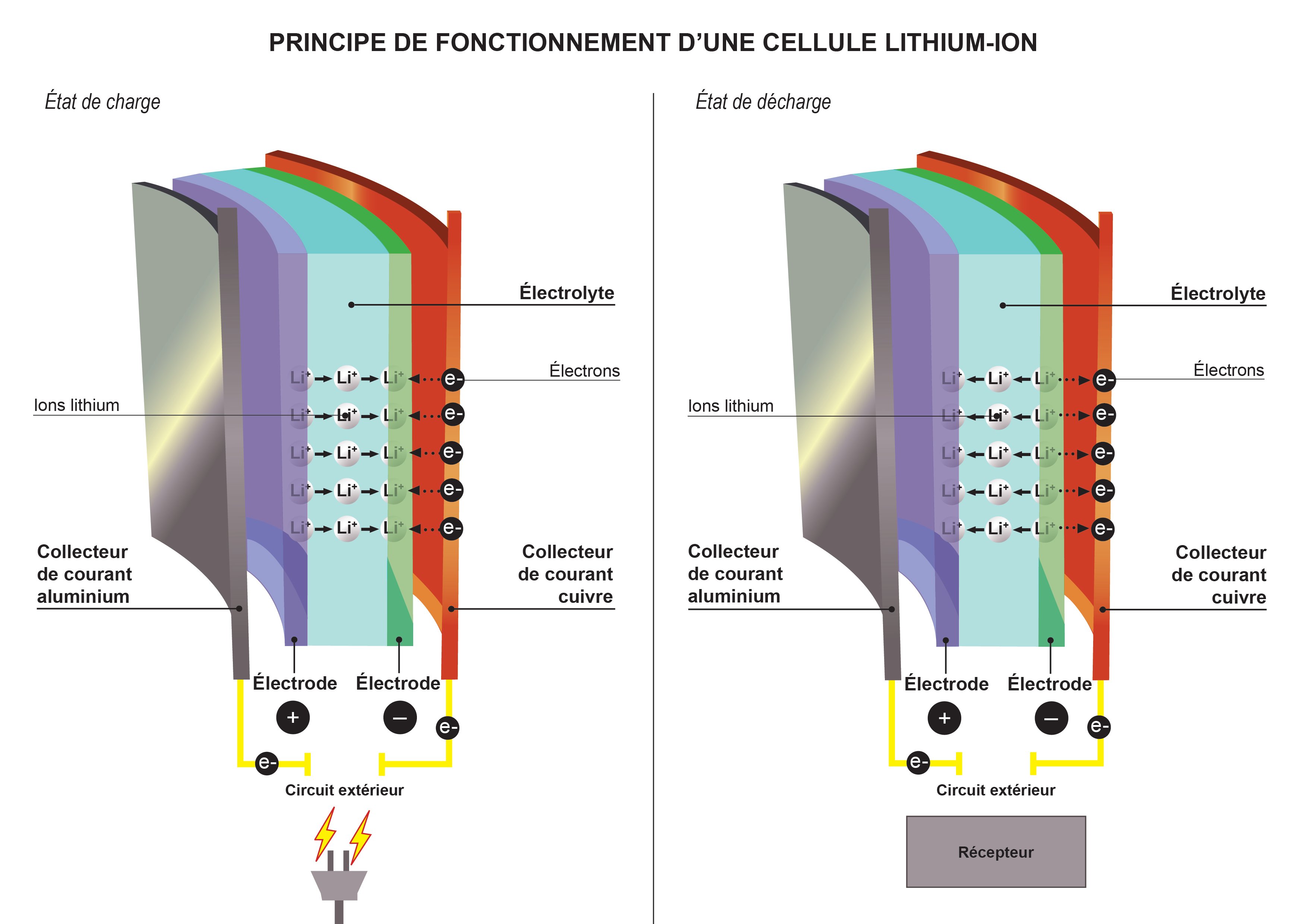
Quand la batterie se charge, les ions de lithium Li+ quittent l’électrode positive (la cathode) et sont stockées dans l’électrode négative (l’anode). Quand elle se décharge, c’est-à-dire quand elle produit le courant électrique, les ions Li+ font le mouvement inverse3.
Ces cellules, de quelques volts chacune, sont regroupées en plus ou moins grand nombre selon la
recherchée pour alimenter un téléphone portable ou une batterie de voiture.
Avantages et inconvénients
La batterie lithium-ion a une haute densité d'énergie, c'est à dire qu'elle peut stocker 3 à 4 fois plus d'énergie par unité de masse que les autres technologies de batteries. Elle se recharge très vite et supporte de nombreux cycles (au moins 500 charges-décharges à 100 %).
En revanche, elle présente un risque d’embrasement soudain de la batterie, avec dégagement de gaz toxiques, dû à l’« emballement thermique » de l’électrolyte au-delà de 100 °C. Des milliers de téléphones et de tablettes portables ont dans les dernières années dû être rappelés par les constructeurs. En 2013, une batterie d’un Boeing 787 s’était embrasée après l’atterrissage.
Selon les enquêtes, l’échauffement vient le plus souvent d’un court-circuit provoqué par des problèmes d’assemblage ou à des chocs. Cela a contraint les producteurs à mettre en place des process de fabrication rigoureux et à intégrer dans la batterie un système électronique (le BMS, Battery Management System) qui coupe le courant dès qu’une anomalie est constatée.
Pour réduire ces phénomènes, les constructeurs étudient aussi des évolutions de la technologie visant par exemple à utiliser un électrolyte solide constitué de films ultraminces en polymère.
De nouvelles « gigafactories » en Europe
La décision d’interdire la vente de moteurs thermique après 2035, impose à l’Europe de rattraper son retard en matière de production de batteries et plusieurs pays en lien avec des constructeurs de véhicules et des startups ont lancé des projets de conception de nouveaux modèles de batteries (au lithium) avec des enjeux de recyclages pour les fabrications à venir.
Ainsi, les projets de « gigafactory », sites consacrés à la production de batteries de plusieurs gigawattheures (GWh) de capacité, se développent pour reprendre à terme une partie du marché aujourd’hui détenu par l’Asie (Chine, Corée du sud ou Japon). Au-delà de la création de ces sites, ce sont les produits eux-mêmes qui font l’objet d’innovations pour équiper les véhicules de demain avec des batteries plus performantes ... et moins chères.
- L’appellation « pile rechargeable » est avant tout de nature commerciale. Il est à noter que la langue anglaise emploie un terme unique, « battery ».
- Voir animation BASF - https://www.youtube.com/watch?v=VXy-IoRykWk